作為天演藥業首個安全抗體技術候選藥物,ADG126(muzastotug)聯合默沙東抗PD-1藥物KEYTRUDA(帕博利珠單抗)實現了更高劑量、更高頻率下的多次重復給藥,展現出同類最佳潛力,同時安全性與帕博利珠單藥療法接近
計劃于9月在2024年歐洲腫瘤內科學會(ESMO)年會上展示ADG126聯合帕博利珠單抗治療轉移性微衛星穩定型(MSS)結直腸癌(CRC)的臨床試驗海報,凸顯其在更多患者樣本中的同類最佳潛質
ADG126展現出的高度差異化的安全性,使得雙藥聯合免疫療法可與標準治療和/或其他治療方式結合,應用到前線治療和其他患者群體
現金結余約9,570萬美元,可支持公司至2026年的運營
天演藥業(以下簡稱"公司"或"天演")(納斯達克股票代碼:ADAG)是一家平臺驅動的臨床階段生物制藥公司,致力于發現并開發以原創抗體為基石的新型療法。公司今日公布了截至2024年6月30日止六個月的財務業績及最新業務進展。
天演首席執行官、董事長兼研發總裁羅培志博士表示:"憑借ADG126聯合帕博利珠單抗后出色的安全性,我們有望開發一款創新雙聯療法,作為免疫治療基石廣泛聯合其他藥物,更好地滿足現有腫瘤免疫療法尚未滿足的患者群體與適應癥。我們始終致力于開發一款既安全又有效的抗CTLA-4療法,如今這一堅定承諾即將取得成果。我們堅信,聯合治療中更高劑量、更高頻率下抗CTLA-4療法的多次重復給藥,將會改善臨床緩解和患者生存。"
ADG126產品亮點
ADG126是一款抗CTLA-4安全抗體SAFEbody?,靶向腫瘤組織中調節性T細胞(Treg)上獨特的CTLA-4表位,與帕博利珠單抗聯用展現出同類最佳潛質。
9月ESMO海報展示
針對MSS CRC的1b/2期臨床試驗的更長隨訪期的數據,包括ADG126(10 mg/kg)聯合帕博利珠單抗的劑量擴展隊列的新增患者數據,將于9月13日至17日在巴塞羅那舉行的2024年歐洲腫瘤內科學會(ESMO)年會上公布。臨床試驗的數據更新將包含以下內容:
更新了針對無肝轉移可評估MSS CRC患者在ADG126 10 mg/kg、每3周給藥(n=12;第一部分)和10 mg/kg、每6周給藥(n=10)劑量下隨訪研究數據,包括部分緩解和病情穩定的持續時間,以及無進展生存期(PFS)和初步總生存期(OS)數據;
新增12名ADG126 10 mg/kg、每3周給藥(第二部分)無肝轉移患者的數據;
2024年美國臨床腫瘤學會胃腸道癌癥(ASCO GI)研討會上公布的既往數據亮點
正在進行的評估ADG126和帕博利珠單抗聯用的1b/2期單臂臨床試驗的第一部分數據顯示,ADG126在6 mg/kg至10 mg/kg的劑量范圍內每3或6周給藥,對經過多線治療的晚期/轉移性實體瘤患者(N=46)顯示出高度差異化的安全性。
46名患者中,未出現3級結腸炎或者4級及5級治療相關不良事件(TRAE)。 5名(10.8%)患者出現3級TRAE,試驗藥物停藥率為6.5%(3/46)。
ADG126 10 mg/kg、每3周給藥與帕博利珠單抗聯用的患者中,13%出現3級TRAE。
ADG126與帕博利珠單抗聯用的安全性與帕博利珠單抗單一療法接近。
針對免疫介導性腹瀉/結腸炎,不到10%的患者使用了如英夫利昔單抗等安全管理藥物。
在針對MSS CRC的劑量擴展試驗中接受ADG126 10 mg/kg、每3周給藥與帕博利珠單抗(200 mg,每3周給藥)聯合治療的無腹膜及肝轉移患者(n=9)中,總緩解率達到22%[2例確認的部分緩解(PRs)]:
該組患者中7名病情穩定(SD),總疾病控制率100% (2例部分緩解,7例病情穩定)。
在一名既往接受過兩線治療,最初未檢測到肝臟病變的肺和淋巴結轉移患者中觀察到確認的部分臨床緩解。該患者治療期間出現明顯的肝臟新病灶的萎縮。
在對這些無肝和腹膜轉移的MSS CRC患者的無進展生存期(PFS)初步分析中,接受ADG126 10 mg/kg劑量,每3周給藥(n=9)和每6周給藥一次(n=6)治療的患者的PFS中位數為7個月。
MSS CRC隊列新增患者
聯合帕博利珠單抗,ADG126 10 mg/kg、每3周給藥一次(第三部分)劑量下新增5名無腹膜和肝轉移患者。
天演同時還在美國和亞太地區評估20 mg/kg負荷劑量后10 mg/kg每3周一次維持劑量下聯合帕博利珠單抗治療的安全性及有效性。10名患者已被納入該給藥方案隊列,計劃于今年晚些時候公布初步結果。
大中華區隊列擴展研究
天演近期在大中華區啟動了ADG126聯合帕博利珠單抗的研究。繼安全性評估之后,公司通過該研究在選定的給藥方案下擴大了針對MSS CRC的劑量擴展隊列,同時考慮覆蓋其他腫瘤類型。
此外,公司還在大中華區啟動了一項小型的單藥針對晚期/轉移性癌癥患者隊列研究(約5例),目前正在評估30 mg/kg、每3周給藥的ADG126單一治療,旨在探索確定ADG126單藥的最大耐受劑量。
在經PD-1治療失敗后出現進展以及PD-L1低表達患者身上觀察到臨床療效
在2024年美國ASCO-GI研討會上展示的三種給藥劑量下的遞增(n=11)試驗中,三名接受ADG126 10 mg/kg、每3周給藥聯合帕博利珠單抗治療的患者身上觀察到兩例確認的部分緩解。兩例已確認的部分腫瘤緩解已持續超過18個月,治療方案同時展示了優異的安全性。其中一名為難治性宮頸癌PD-1耐藥患者,該宮頸癌患者在既往兩線治療(包含9個周期的帕博利珠單抗單一療法)后出現疾病進展。另一名為子宮內膜癌患者。
2024年美國ASCO-GI研討會上公布的數據還顯示,一位頭頸部鱗狀細胞癌患者在接受ADG126 10 mg/kg、每6周給藥與帕博利珠單抗聯用治療(n=17)后觀察到確認的部分緩解。患者既往未接受過免疫治療,CPS評分較低,且觀察到靶病灶完全萎縮。
在MSS CRC伴肝轉移患者身上觀察到的治療效果
在一項評估ADG126聯合抗PD-1藥物特瑞普利單抗(240mg,每3周給藥)的隊列研究中,從兩例經過三線治療MSS CRC伴肝轉移癌患者身上觀察到腫瘤顯著縮小:
一名伴有肺、淋巴結和肝轉移的患者靶病灶縮小了30%以上(ADG126 10 mg/kg,每3周給藥)。由于存在新的病灶,根據RECIST實體瘤療效評價標準,該響應不被視為客觀緩解。
第二名患者(ADG126 6 mg/kg,每3周給藥)的兩個肝臟靶病灶縮小了21%(分別縮小55毫米和48毫米)。
此外,在一項評估ADG126的非掩蔽型親本抗體ADG116(3 mg/kg,每3周給藥)與帕博利珠單抗聯用療法的劑量遞增隊列(n=6)研究中,一名經過五線治療失敗后的肝轉移患者的癌胚抗原(CEA)水平顯著下降。該試驗數據已在2022年美國癌癥免疫治療學會(SITC)年會上以海報形式公布。
其他安全抗體研究管線
經過Fc端優化的抗CD137 IgG1 掩蔽型POWERbody強力抗體ADG206針對晚期/轉移性腫瘤患者的1期臨床試驗正在進行中:
正在進行的1期臨床試驗已招募13名患者,以評估新一代抗CD137候選藥物ADG206的安全性、有效性和耐受性。目前正在開展劑量水平為6 mg/kg且每3周給藥一次的劑量遞增試驗。尚未達到最大耐受劑量(MTD)。
臨床前數據表明,ADG206在多種腫瘤模型的單一療法中具有良好的耐受性與抗腫瘤活性,激活的ADG206對CD137激動型活性相較于基準抗體(urelumab烏瑞蘆單抗類似物)強4倍。后者在臨床實驗中,每3周給藥一次的劑量水平下MTD為0.1 mg/kg,同時顯示出劑量依賴性肝毒性。
新一代抗CD137候選抗體ADG206是首個進入臨床開發階段的經過Fc端優化的掩蔽型POWERbody強力抗體候選藥物,應用了公司精準掩蔽、Fc端優化與創新表位技術,以應對CD137靶點安全性與有效性的挑戰,展示天演動態安全抗體研發和掩蔽平臺的廣泛適用性。
由安全抗體SAFEbody?精準掩蔽技術開發的候選藥物在新藥臨床申報階段(IND-enabling)研究中展現出多功能性和同類最佳安全潛質。目前候選藥物包括兩款處于新藥臨床申報階段的掩蔽型CD3T細胞接合器(TCE),具有較長的半衰期和優異的臨床前安全性,在非人類靈長類動物研究中其細胞因子釋放綜合征(CRS)得到有效控制,此外其他應用SAFEbody平臺開發的藥物如下:
ADG138是一種雙掩蔽抗CD3×HER2抗體,在HER2高表達和低表達實體瘤中均具有較高的治療指數,因此可作為單一藥物進行開發或與其他免疫調節劑聯合用于HER2表達的實體瘤的治療。
ADG152是一種雙特異性抗CD3×CD20 T細胞接合器,結合安全抗體SAFEbody精準掩蔽技術,可最大限度地抑制細胞因子釋放綜合癥(CRS)以及降低結合非腫瘤組織里的靶標而產生的毒性,從而提升治療指數。ADG152的抗CD20結合臂提升了與CD20的結合力,抗CD3結合臂則是運用安全抗體SAFEbody技術量身打造,具有精準的掩蔽性。臨床前數據顯示,ADG152在不同劑量水平下可以誘導強烈且持續的B細胞耗竭。
ADG153是高度差異化的IgG1亞型抗CD47掩蔽抗體,具有強大的抗體依賴性細胞毒性(ADCC)和抗體依賴性細胞吞噬(ADCP)活性。ADG153采用SAFEbody掩蔽技術設計,具有活性Fc片段,可充分發揮抗CD47藥物治療血液瘤和實體腫瘤的潛力。
CD28雙特異性T細胞接合器可與CD3雙特異性T細胞接合器和/或檢查點抑制劑相結合,創造安全持久的T細胞介導協同免疫治療方案,擁有巨大的治療潛力。臨床前數據表明,通過打造靶向高度保守的獨特表位,具備跨物種交叉反應的定制抗體,CD28激活時產生的嚴重安全問題有望得到緩解。
商務合作
Exelixis:天演和Exelixis正根據雙方達成的技術授權協議開展合作,使用天演的安全抗體SAFEbody精準掩蔽技術開發新型掩蔽型安全抗體偶聯藥物。該協議于2021年2月簽署,根據協議條款,Exelixis向天演藥業支付兩款安全抗體候選藥物項目的預付款1,100萬美元。天演將有權獲得潛在里程碑付款以及針對各個靶點開發的產品分級特許權使用費。迄今為止,天演因成功篩選到目標安全抗體SAFEbody候選藥物已獲得600萬美元的里程碑付款。
賽諾菲:根據2022年3月公布的合作協議,天演與賽諾菲合作開發雙特異性和單克隆SAFEbody候選抗體,利用天演的安全抗體SAFEbody精準掩蔽技術研發臨床前候選抗體,由賽諾菲進行開發和商業化。
羅氏:羅氏贊助并開展一項跨國1b/2期臨床試驗,評估ADG126聯合阿替利珠單抗和貝伐珠單抗之三聯免疫療法在晚期肝細胞癌(HCC)一線治療中的效用。到目前為止,這一聯合療法表現出良好的耐受性。天演保留對ADG126的全球開發與商業化權利。
2024年里程碑與可持續至2026年的現金儲備
天演預計公司資金可支持公司到2026年的運營活動,并預期將在大型醫學會議上公布目前正在進行的ADG126聯合帕博利珠單抗針對MSS CRC治療的多項研究數據。
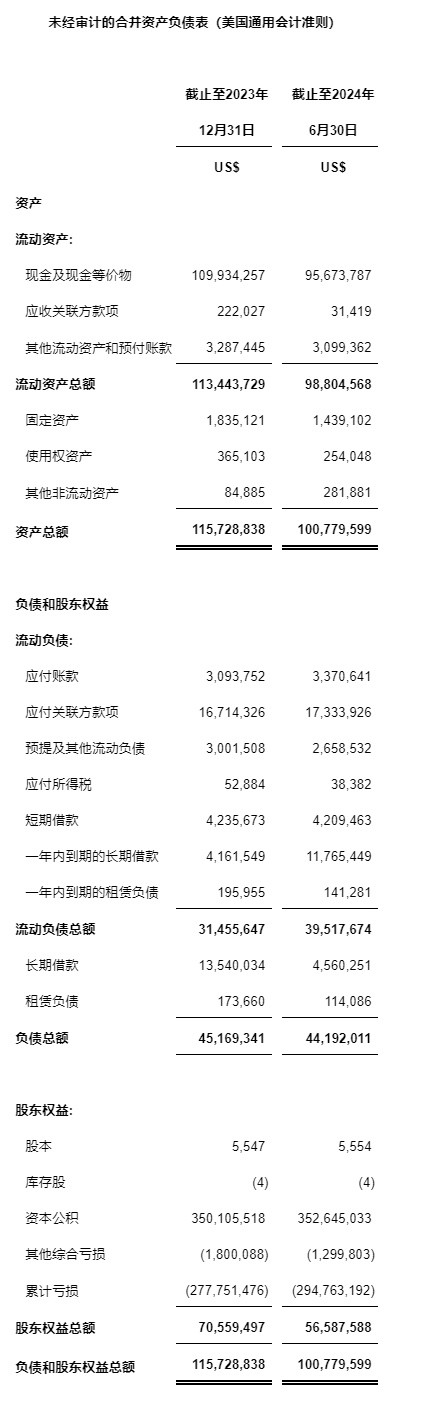
財務亮點
現金和現金等價物
現金和現金等價物2023年12月31日約1.10億美元,2024年6月30日約0.96億美元。截至2024年6月30日,公司從中國境內各商業銀行獲得的人民幣貸款由2023年12月31日的2,190萬美元減少至2024年6月30日的2,050萬美元。從貸款中所獲得資金主要用來支付公司在中國境內產生的研發費用。
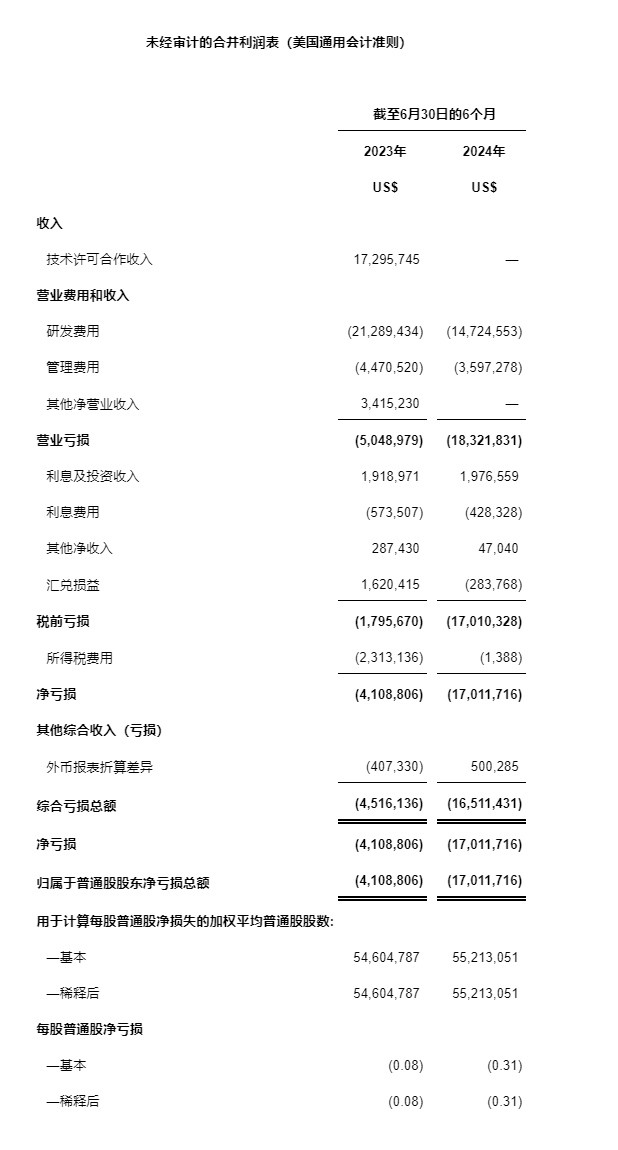
凈收入
相較于2023年同期的930萬美元,公司2024年上半年尚未確認收入。公司2024年上半年沒有簽訂新的客戶合同,且尚未達成現已簽訂的客戶合同內包含的履約義務。
研發費用
相較于2023年同期的2,130萬美元,公司2024年上半年的研發費用約為1,470萬美元。研發費用同比下降了約31%。該下降源于公司重點優先發展針對抗CTLA-4的安全抗體療法的ADG126臨床項目。
管理費用
相較于2023年同期的450萬美元,公司2024年上半年的管理費用約為360萬美元。管理費用的下降主要是由于成本控制措施所帶來的人工成本的減少。
其他凈營業收入
相較于2023年同期的340萬美元,公司2024年上半年的其他凈營業收入為0。該340萬美元其他凈營業收入包含了從一家合同制造商處獲得的,與一份臨床前項目外包協議相關的一次性補償款。
凈虧損
相較于2023年同期的410萬美元,公司2024年上半年的凈虧損約為1,700萬美元。
流通在外普通股
截至2024年6月30日,公司流通在外的普通股為55,338,480股。每一股美國存托股票(ADS)可換算為1.25股普通股。
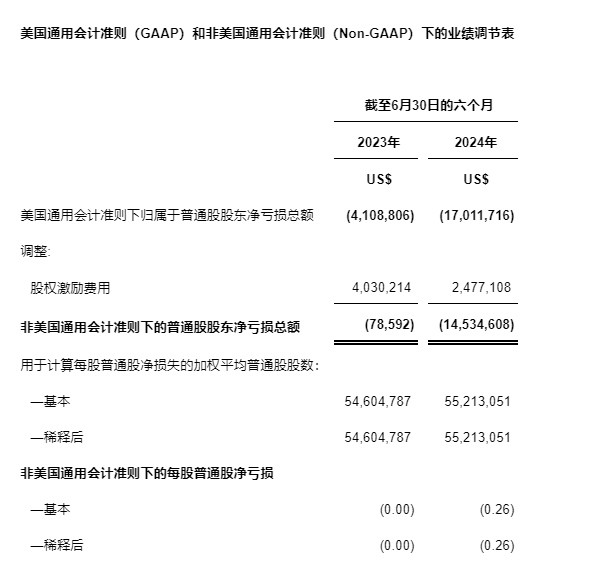
非美國通用會計準則(Non-GAAP)下的虧損
非美國通用會計準則下的凈虧損定義為該期間的美國通用會計準則下的凈虧損剔除股權激勵費用。相較于2023年同期的8萬美元,公司2024年上半年非美國通用會計準則下的凈虧損約為1,450萬美元。請參閱本新聞稿中題為"美國通用會計準則(GAAP)和非美國通用會計準則(Non-GAAP)下的業績調節表"部分了解詳情。
天演藥業使用Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損,用于評估本公司的經營成果,以及財務和經營決策。本公司認為,Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損有助于識別本公司業務的基本趨勢,而這些趨勢可能因本公司計入本期間虧損的某些費用的影響而扭曲。本公司認為,Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損提供了有關其經營成果的有用信息,整體提升了對其過去業績和未來前景的全面了解,并使管理層在財務和運營決策中使用的關鍵指標更具可見性。
對于本期間的Non-GAAP財務指標的衡量,天演藥業使用的Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損不應單獨被考慮,也不應被視為該期間的營業利潤、凈虧損或任何其他業績衡量指標的替代品,或作為其經營業績的衡量指標。公司鼓勵投資者審閱該年度的Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損,并審閱最直接可比的美國通用會計準則下財務指標的調整過程。此處所列期間的Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損可能無法與其他公司提供的類似名稱的財務指標相比較。其他公司可能會以不同的方式計算類似的財務指標,從而限制了它們作為公司可比數據的有用性。天演藥業鼓勵投資者和其他人全面審閱本公司的財務信息,而不是僅僅關注于單一的財務指標。
本期間計算的凈利潤指標下Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損,不包括股權激勵費用。股權激勵費用是向員工授予股票激勵所產生的非現金費用。本公司認為美國通用會計準則和非美國通用會計準則的調整信息能對管理層和投資人在進行公司運營表現的同期比較以及同業比較時有所助益。其原因有:(i)在某特定期間內的股權激勵費用與公司的運營表現未必直接相關;(ii)因公司授予新的股權激勵計劃的時間安排,股權激勵費用在不同期間內可能會發生較大變化;以及,(iii)其他公司可能采取不同的股權激勵形式或者使用不同的估值方法。
請參閱本公告結尾的 "美國通用會計準則(GAAP)和非美國通用會計準則(Non-GAAP)下的業績調節表",獲取本期間Non-GAAP凈虧損和Non-GAAP的每股普通股凈虧損的完整的調整過程。
關于天演藥業
天演藥業(納斯達克股票代碼:ADAG)是平臺驅動并擁有自主平臺產出的臨床產品開發階段的生物制藥公司,公司致力于發現并開發以原創抗體為基石的新型癌癥免疫療法。借力于計算生物學與人工智能,憑借其全球首創的三體平臺技術(新表位抗體NEObody,安全抗體SAFEbody及強力抗體POWERbody),天演藥業已建立起聚焦于新型腫瘤免疫療法的獨特原創的抗體產品線,以解決尚未滿足的臨床需求。天演已和多個全球知名合作伙伴達成了戰略合作關系,并以其多種原創前沿科技為合作伙伴的新藥研發賦能。
如需了解更多信息,請訪問:https://investor.adagene.com。并關注天演藥業微信、領英及推特官方帳號。
SAFEbody?為天演在美國、中國、澳大利亞、日本、新加坡和歐盟的注冊商標。
安全港聲明
本新聞稿包含前瞻性陳述,包括關于臨床數據對患者的潛在影響的陳述,以及天演藥業的推進和預期的臨床前活動、臨床開發、監管里程碑以及其候選產品的商業化。由于各種重要因素,包括但不限于天演藥業證明其候選藥物的安全性和有效性的能力,實際結果可能與前瞻性陳述中所示的結果存在重大差異;其候選藥物的臨床結果,可能不支持進一步開發或監管批準;相關監管機構就天演藥業候選藥物的監管批準做出決定的內容和時間;如果獲得批準,天演藥業為其候選藥物取得商業成功的能力;天演藥業為其技術和藥物獲得和維持知識產權保護的能力;天演藥業依賴第三方進行藥物開發、制造和其他服務;天演藥業有限的經營歷史以及天演藥業獲得額外運營資金以及完成其候選藥物的開發和商業化的能力;天演藥業在其現有戰略伙伴關系或合作之外簽訂額外合作協議的能力,以及COVID-19 流行對天演藥業臨床開發、商業和其他運營的影響,以及在天演提交給美國證券交易委員會的20-F形式的2022年的年度報告中"風險因素"部分更充分討論的那些風險。所有前瞻性陳述均基于天演藥業當前可獲得的信息,除非依照法律之可能要求,天演藥業不承擔因新信息、未來事件或其他原因而公開更新或修改任何前瞻性陳述的義務。